La disbiosi intestinale è stata associata a varie patologie tra cui HIV, malattie reumatologiche e IBD. Il meccanismo patogenico alla base delle spondiloartriti IBD-associate è ancora oggetto di indagine. Lo studio in oggetto confronta una coorte di pazienti con spondiloartrite IBD-associata e una di pazienti IBD senza spondiloartrite, dimostrando la presenza delle seguenti alterazioni: aumento dell’infiltrazione batterica e compromissione delle tigh-junction a livello dell’epitelio intestinale; aumento di marcatori sieriche quali intestinal fatty acid binding protein (I-FABP), lipopolysaccharide (LPS) e soluble CD14 (sCD14); aumento di monociti pro-infiammatori (CD80+CD163+) nel siero. In sintesi, si dimostra come la disbiosi intestinale, espressa da un’alterata permeabilità intestinale, una traslocazione batterica dall’intestino al circolo ematico, e un’attivazione immunitaria sistemica, sia un importante meccanismo implicato nella genesi delle spondiloartriti (sia assiali che periferiche) IBD-associate.
BACKGROUND
Negli ultimi anni l’attenzione e il numero di studi riguardanti il microbioma intestinale è aumentato enormemente. Il concetto alla base di questo interesse è che l’alterazione della flora batterica intestinale (la cosiddetta disbiosi) e l’esposizione sistemica di antigeni batterici provenienti dall’intestino possano essere alla base di numerose patologie, principalmente immuno-mediate. Nello specifico, è stato recentemente dimostrato come i pazienti affetti da spondilite anchilosante (AS) presentino aumentati dei livelli sierici delle seguenti proteine: intestinal fatty acid binding protein (I-FABP), indicativo di aumentata permeabilità intestinale; lipopolysaccharide (LPS), indicativo di traslocazione batterica dall’intestino; soluble CD14 (sCD14), indicativo di attivazione immunitaria sistemica. Partendo da questi presupposti, lo studio in oggetto si propone di indagare queste alterazioni in pazienti con spondiloartrite (SpA) associata a IBD. Per questo scopo sono stati dosati i marcatori sierici sopra citati, ed è stata analizzata la composizione batterica e l’integrità delle giunzioni cellulari su biopsie ileali, in pazienti con SpA-IBD confrontati con pazienti IBD senza SpA, con AS senza IBD e con soggetti sani.
RISULTATI
Sono stati analizzati i sieri di 85 pazienti con SpA-IBD, confrontati con 30 sieri di pazienti IBD, 20 di pzienti con AS e 20 di soggetti sani. Sono state analizzate 10 biopsie ileali di pazienti con SpA-IBD, 10 di pazienti con IBD e 10 di soggetti sani.
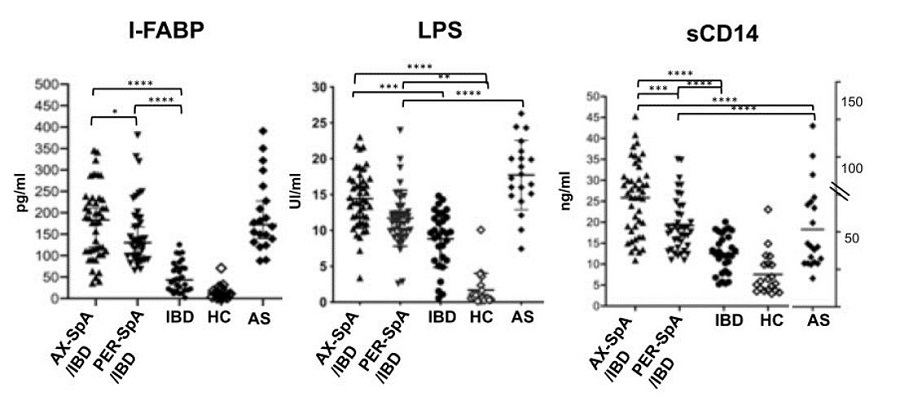
Aumento dei livelli di I-FABP, LPS e sCD14 nei pazienti con SpA-IBD
I pazienti con SpA-IBD erano caratterizzati da aumentati livelli di I-FABP, LPS e sCD14 rispetto sia ai pazienti IBD sia ai soggetti sani (p<0,001 per entrambe i confronti). Tale differenza era più marcata nei pazienti con spondilite assiale IBD-associata, rispetto ai pazienti con patologia articolare periferica; i primi presentavano infatti valori di I-FABP analoghi ai pazienti con AS (senza IBD), e significativamente superiori rispetto ai pazienti con SpA periferica. Non è stata invece evidenziata alcuna differenza fra i pazienti IBD e i soggetti sani.
Questi risultati sono riassunti nella figura sottostante.
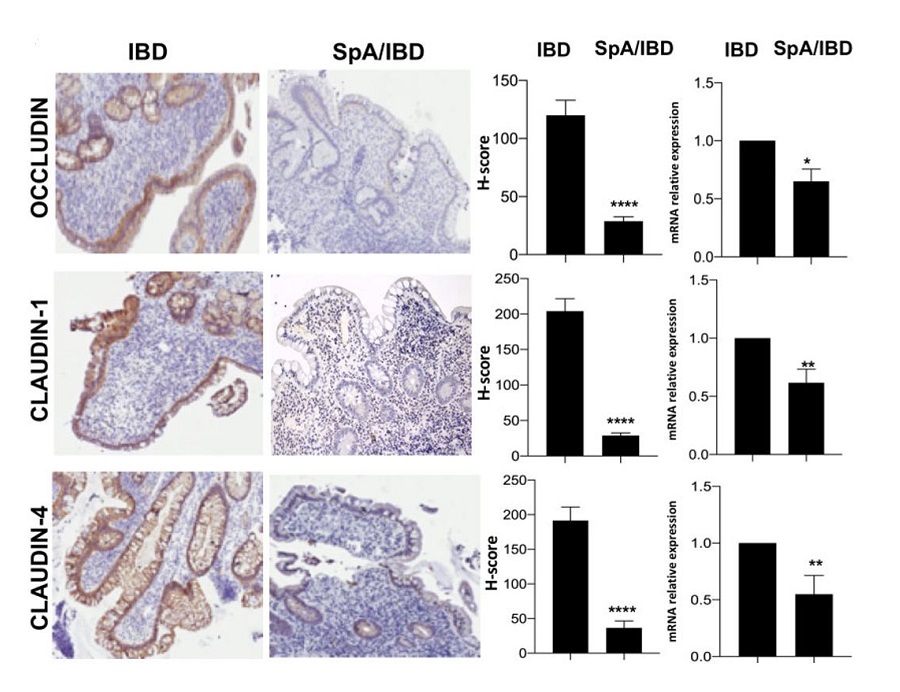
Infiltrazione batterica e compromissione della barriera epiteliale nell’ileo dei pazienti con SpA-IBD
Mediante specifiche colorazioni sulle biopsie ileali, un’infiltrazione mucosale di batteri Gram negativi entero-aderenti ed entero-invasivi è stata riscontrata nei pazienti con SpA-IBD, ma non nei pazienti con IBD o nei soggetti sani. Come mostrato nella figura sottostante, tramite analisi immunoistochimica e amplificazione molecolare (PCR), è emerso che nell’epitelio intestinale dei pazienti con SpA-IBD vi è una riduzione delle proteine componenti delle tigh junctions (occludin, claudin-1, claudin-4), e una downregolazione dei geni delle proteine stesse, rispetto ai pazienti con IBD. Nessuna differenza è stata rilevata fra i due sottogruppi di SpA (periferica o assiale).
Aumento di monociti pro-infiammatori nel siero dei pazienti con SpA-IBD
Sono state analizzate 3 proteine di parete cellulare, espresse usualmente dalle cellule dell’immunità innata: CD14, tipicamente espresso dai macrofagi e implicato nel legame di questi con LPS; CD80, proteina di parete importante per il legame, e quindi per l’attivazione, dei monociti-macrofagi con i linfociti T; CD163, recettore scavenger responsabile del riconoscimento dei batteri da parte dei monociti-macrofagi. Nel siero dei pazienti con SpA-IBD è stata evidenziata una maggiore presenza di cellule CD14+ co-esprimenti CD80 e CD163 rispetto ai pazienti IBD e ai soggetti sani. Questo dimostra una maggiore attivazione sistemica dell’immunità innata nei pazienti con SpA.
IMPATTO NELLA PRATICA CLINICA
Rispetto agli studi clinici, l’impatto sulla pratica clinica di studi sperimentali è meno intuitivo, ma non meno importante. Infatti, solo la comprensione accurata dei meccanismi patogenici alla base delle malattie permette lo sviluppo di test diagnostici innovativi e di terapie sempre più efficaci e mirate.
Lo studio presentato suggerisce come la disbiosi intestinale abbia un ruolo importante nello sviluppo della spondiloartrite in pazienti con IBD. Disbiosi che si manifesta attraverso un’aumentata permeabilità intestinale, una traslocazione batterica dall’intestino al circolo ematico, e un aumento di alcuni marcatori sierici. Il risvolto diagnostico potenziale è chiaro: il dosaggio di specifici marcatori sierici (es. I-FABP, sCD14) potrebbe essere utile per supportare la diagnosi di spondiloartrite nei pazienti con IBD. Inoltre, la variazione dei marcatori sierici nel tempo aiuterebbe nel monitoraggio della risposta alle terapie specifiche.
Di grande interesse anche il risvolto terapeutico: opzioni farmacologiche che agiscano sulla composizione della flora batterica intestinale e sull’integrità della barriera epiteliale potrebbero contribuire in futuro al controllo dell’infiammazione articolare nei soggetti con spondiloartrite IBD-associata. Studi a riguardo sono stati recentemente pubblicati e sono tutt’ora in corso, con risultati promettenti.
COMMENTO
L’interesse per lo studio in oggetto è duplice. Da un lato conferma la disbiosi come meccanismo patogenico importante per lo sviluppo delle patologie immuno-mediate. Dall’altro, più generale, è importante per il significato concettuale che riveste: l’avanzamento nella comprensione dei meccanismi patogenici delle malattie è fondamentale per lo sviluppo di nuovi strumenti diagnostici e di terapie efficaci e selettive.